

在我们的媒体中心
您可以查阅公司新闻稿
在市场和政策的驱动下,越来越多的制药企业走上转型之路。但转型的重重困难,让不少企业举步维艰。
而海普瑞的转型已初见成效,这对于一家有着23年历史的老牌药企来说,并不容易。
成立于1998年的海普瑞,在早期一直以单一的肝素原料药闻名。
*肝素,抗凝药物之一。
但到如今,海普瑞已经形成了肝素产业链、CDMO(定制研发生产组织)、创新药三大业务板块。2020年,海普瑞总营收53亿元,同比+15%。其中:
与转型同样令人欣喜的是,海普瑞连续23年盈利,通过2020年在港股上市,成为“A+H”跨国制药企业。
海普瑞是如何一步步突破过去历史的桎梏拨云见日?对于各个板块的未来发展,海普瑞又有着怎样的规划?
带着这些问题,医趋势采访了海普瑞集团首席商务官韩涛女士。

海普瑞首席商务官韩涛女士
*韩涛拥有 23 年专注的跨国医药商务战略经验,曾任基石药业企业发展部副总裁、亚盛医药企业发展部负责人及副总裁、艾伯维制药美国全球血液肿瘤商务洞察战略总监、KantarHealth中国区项目负责人,也曾在百时美施贵宝美国总部任职。毕业于美国康涅狄格州州立大学,获MBA工商管理学位。
1998年,四川大学化学系毕业、一直对肝素钠原料药研究有着深厚兴趣的李锂携其夫人李坦一起创立了海普瑞。
2008年,“百特事件”爆发——肝素粗品的硫化物污染在美国造成80余人死亡,FDA对美国市场所有肝素产品进行严格审核,来自中国深圳的海普瑞成为唯一的通过质量审查的企业。
由此,海普瑞声名鹊起,并供应当时全美95%以上的肝素原料需求。
与一般中国公司在中国营收占比很高的情况不同,一直以来,海普瑞的海外营收占比之高,是呈压倒性的。
2020年,海普瑞在海外市场营收48亿元,占总营收的90%。
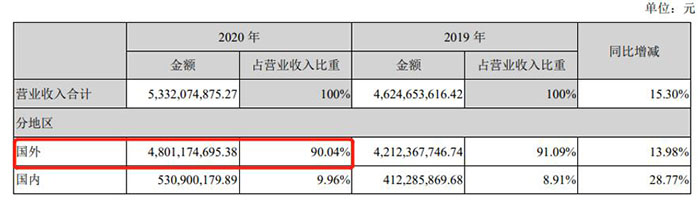
2020年,海普瑞区域营收数据
这与国内外市场环境差别有关。
一方面,海外市场尤其是欧美,肥胖、心血管患者比例相对较高,使得欧美市场成为肝素最大的消费区。
另一方面,中国医患对于抗凝药物的使用观念与国外有很大不同,中国人的观念上比较怕出血,因此对于抗凝药物使用非常保守。欧洲患者对于依诺肝素的使用量最高达到每天1剂,中国患者的平均用量10天1剂可能都达不到。且中国药典对于低分子肝素没有制定标准,市场上的肝素产品鱼龙混杂。杂牌低分子肝素钠和低分子肝素钙成为中国独有的现象。
在海外市场,海普瑞的脱颖而出,离不开对质量的坚守。
“质量来源于严格的源头控制以及工艺流程。” 韩涛表示,“海普瑞致力于从上游源头把控每一根猪小肠的可追溯性。不符合标准的原材料,我们直接弃用,这会带来成本的上升,但对于质量,我们绝不妥协。”
在生产方面,海普瑞拥有多项国际领先专有技术,以此保证产品质量、纯度、基团完整性。其原料药和无菌制剂工厂,包括预灌针和西林瓶生产线多次通过中国、美国、欧盟、澳大利亚、巴西等国的GMP现场检查,包括6次零缺陷通过美国FDA检查。
2020年,海普瑞依诺肝素制剂的欧洲市场份额达到20%左右,但PV case(药物警戒)占比仅6%,这充分说明了海普瑞的依诺肝素制剂的安全性,也是2016年其产品以首个依诺肝素钠注射液的生物类似药在欧盟获批的原因之一。
海普瑞广为流传的”达摩克利斯剑”故事是其质量可靠的另一重印证。
2013年,美国FDA驻中国飞行检察官因接到举报信而登门突击检查海普瑞天道肝素粗品生产线,然而经过5天的严格检查,生产线完全符合标准。
FDA检察官对海普瑞创始人李锂说:“我带着达摩克利斯剑来到你们公司,走时却想送给你们一束鲜花。”
在肝素原料药确立了领先地位后,海普瑞开始谋求多元化转型。时至今日,制剂、创新药、CDMO板块均做得有声有色。
对于转型制剂,韩涛直白表示,“所有的肝素原料药企业最终都会向制剂转型。因为肝素原料药是从猪小肠中提取的,受上游价格波动影响很大,制剂业务端的价值无疑更高。作为肝素钠原料药的全球领先生产供应商,海普瑞转型制剂也可谓是顺理成章。”
资料显示,2011-2018年,海普瑞收购整合了10多家企业,扩充肝素产业链两端,完成了从粗品收购到终端制剂的产业链的“纵向”打通。
其中,最为著名是对美国SPL以及中国多普乐的收购,由此,海普瑞完成了全球化肝素原料药生产、研发和销售体系,进一步保障了公司肝素钠产品原料药供应的稳定性和安全性。
在地域上,海普瑞亦实现了横跨中国、美国、欧盟等地的“横向”覆盖。
2016年,海普瑞依诺肝素钠注射液获批进入欧盟市场。面对陌生的市场,海普瑞采取”双管齐下”的策略——在德国、意大利等国家自建销售团队,从市场准入、产品上市,到市场推广,全部自己负责,成为了首个在欧洲自建营销团队的中国制药企业;在波兰、英国等国则通过强有力的合作方,加速市场准入。
目前,海普瑞旗下依诺肝素钠制剂目前已在全球近60个国家实现销售,预期在2021年主要市场占比会进一步提高。
未来5年,海普瑞期望成为肝素制剂领域的全球领军企业之一。
在创新药板块,海普瑞通过股权投资及区域权益获取,已持有在研新药品种超过20个,覆盖30多种适应症。其中,10个持有大中华区全部权益的品种中,已有3款药物开发处于全球III期临床阶段。3款处于全球III期临床阶段的药物,分别为:
3款处于全球III期临床阶段的药物,分别为:
“海普瑞投资的赛道很冷门,但是不小众,所有药物均属于同类首创,且适应症人群庞大。”韩涛说。
比如,针对一线原发卵巢癌患者而开发的oregovomab,由于是通过激活针对肿瘤抗原的特异性T细胞来起效,因此无须筛选特定的靶点人群,而且所需剂量极低,每次只需给药2mg,一个疗程一共4次。
中国每年有超过5万名新发卵巢癌患者,一线原发卵巢癌患者的治疗方案也已有10多年未发生变化。II期试验中,oregovomab将一线原发卵巢癌患者使用标准治疗(SOC)卡铂+紫杉醇的中位无进展生存期从12.2个月显著延长至41.8个月(p=0.0027)。
目前oregovomab已经获得美国FDA授予快速审评及罕见病药物认定。
韩涛对医趋势表示:“海普瑞拥有稳定现金流,这决定了我们在筛选管线品种时可以尊重自己的价值观,重点关注药物是否能让大多数的患者获益,能否真正满足临床未满足需求。”
另一款药物apabetalone(RVX-208)是BET溴结构域小分子抑制剂,凭借与包括高强度他汀类药物在内的最佳标准疗法的联合,用于近期出现急性冠状动脉综合征的2型糖尿病患者主要不良心脏事件的二级预防(MACE)。
apabetalone(RVX-208)于2020年1月一举拿下心血管领域5年来第二个美国突破性认证(BTD)。
中国有1.2亿的糖尿病患者,其中71%有MACE预防需求。这款药物如能顺利上市则将拥有广阔的市场前景。
tosatoxumab(AR-301)是针对金黄色葡萄球菌α-毒素的全人源IgG1 单克隆抗体,正用于攻克金黄色葡萄球菌性呼吸机相关性肺炎这一世界医院的难题。该药已经拿到美国FDA颁发的快速审评资格认定,欧洲药品管理局(EMA)给与的孤儿药资格认定,
目前,oregovomab在全球已经完成19例患者入组;tosatoxumab 则已经实现了中国三期临床的首例患者给药。
预计最快2023年第四季度,海普瑞可能获得创新药板块营收。
2015年,海普瑞通过收购美国赛湾生物进入大分子CDMO领域。2020年,CDMO业务营收占总营收的15%。
一方面是市场发展的红利,生物大分子药物、微生物病毒载体/非病毒载体、细胞治疗、基因治疗和mRNA疫苗等领域的研发、临床和商业化品种越来越多,产业化分工导致CDMO行业可以独立发展壮大,服务和赋能各类创新药企业。
另一方面,赛湾凭借优秀的工艺开发、准时交付以及成功的运营能力,在2020年开始为全球大规模上市的两个mRNA新冠疫苗提供所需全部关键酶的生产服务。
目前,赛湾已经签订的在手订单已经接近一亿美元。
赛湾还可以为海普瑞的创新药开发以及投资机会探测提供协同和助力,与中国总部的生产线也能达成协同。
例如,目前oregovomab临床试验所需的药物由赛湾生产,而海普瑞总部的预灌针/西林瓶年产能超过3亿剂,且生产线和厂房拥有通过包括美国、欧盟在内的数十个国家cGMP认证。
因此,在后疫情时代,赛湾可以和海普瑞总部的MO联动,切入mRNA疫苗生产,并且搭载海普瑞的全球销售网络快速供货全球。
“中国本土创新公司不能光‘买进来’,未来更应该要走出去。海普瑞的全球销售网络同样也可以赋能中国本土创新产品的全球化准入和商业化。”韩涛说。
在第三个10年,海普瑞开启了A+H双融资平台的新发展时代。
在向国际领先进发的过程中,“肝素产业链带来持续增长的现金流,是我们的立足之本,CDMO和创新药是现在和已经可以看到的未来。海普瑞会充分将这三大板块的优势发挥出来。” 韩涛这样定位。
对于各个板块的未来发展,韩涛打了个比方,“一个家里有三个孩子,都三十几岁了,还让他们住在同一个屋子里,显然不太合理。接下来的两三年里,我们会分别为这三个板块制定各自独立的发展规划。”
对于中国市场,韩涛对医趋势表示:“老龄化有望带来中国肝素市场的扩增。
2020年10月,海普瑞肝素所有在售规格的产品均通过了仿制药一致性评价,是目前国内唯一一家。
从药物安全有效性来说,海普瑞的依诺肝素钠注射液都已经经过了包括欧美在内的国内外的验证,而且支付性也相当具有竞争力。作为一家立足于中国的企业,未来希望自己的老百姓也可以和国外患者一样从我们的产品中获益。
此外,我们会加速推进创新管线的临床开发和商业化落地,争取让创新药物可以尽快造福大中华区的患者,满足临床需求。”
在采访过程中,履新仅半年的韩涛对于海普瑞相关信息如数家珍。选择加入海普瑞,是她认为最正确的决定之一。
“我的职业生涯前16年都呆在美国。我强烈希望能把自己所学带到中国,做更多的事情。”这是韩涛回国的动力。
但致力于推动实施“商业化研发”的韩涛,很快遇到阻力。
商业化研发指在设计药物临床的时候就考虑到未来产品上市时所面临的竞争格局和商业化前景。商业化研发能够帮助企业避免出现PD-1/L1领域扎堆厮杀的情况。
由于国内每个赛道都在拼命抢时间,以肿瘤药物为例,通常会选择小适应症切入,这样对于患者数量的要求不高,临床也可以很快做完实现商业化,之后再慢慢拓展适应症。
而韩涛所说的商业化研发,每个TPP(Target Product Profile)至少需要三个月的时间来推敲经过反复验证的商业化研发设计方案。
“大多药企MNC的中国分部不做商业化研发,因为总部承担了这样的职能。新成长起来的中国biotech,在资本压力下也无法真正做商业化研发,因为等不了。”韩涛直言。
韩涛职业生涯中最有成就感的事情,是将商业化研发融入艾伯维享有盛名的Venclexta的临床设计。

韩涛获艾伯维全球总裁奖照片(芝加哥总部)
“Venclexta在rrCLL 17p适应症加速获批后,推进的第二个AML适应症就是商业化研发的结果。通过市场验证和商业化洞察,我带领的团队发现了一类在治疗上被‘三不管’的患者。
如果按照指南的分型进行适应症设计,当时可能只有40%的市场份额,而通过我们的发现,我们及时扩大了临床适应症范围,最终市场份额提升到了55%以上。”
说起自己感兴趣的领域,韩涛不由语气中带着兴奋和一点点骄傲,“商业化研发的价值,在于以终为始来看临床设计,做出差异化,最终找到一个蓝海市场切入。当然如果是评估完之后其实并没有商业化前景的项目,也应该及时止损叫停。”
“我觉得自己是有一点点使命感的。为什么我坚持推广商业化研发?就是希望做出来的药最后能够真正帮助到患者。”
吸引韩涛加入的海普瑞,同样是一家具有使命感的公司。
“在海普瑞,由于有稳定的现金流,创始人完全支持在新药研发的过程中采取商业化研发的方法,从源头上就把事情做对。深挖之下你会发现,海普瑞其实是一个宝藏公司。不浮躁,不慕名,不仅凭商业利益驱动,而是踏踏实实把一件事情做到极致,这在这个时代是非常难能可贵的品质。
我们希望能够吸引更多抱着同样的情怀和使命的人才加入,与我们同行,让海普瑞为患者和整个行业创造更大的价值。”
快问快答
请用三个词来描述海普瑞。
韩涛:科学、严谨、良心。
一个成功的职业经理人,需要具备哪些重要品质?
韩涛:领导力、洞察力、决断力以及很好的沟通能力。
您最喜欢哪种类型的员工?
韩涛:第一,具备主人翁意识,也就是自驱力;第二,能够充分地表达自己不同的意见,但是坚决地执行。
您觉得自己身上最独特的品质是什么?
韩涛:乐观。
您对成功的定义是什么?
韩涛:天天在做一件喜欢做的事情,能够坚持做下去,而且觉得快乐。
您对职场女性想说的一句话是?
韩涛:坚定信念。
本文转载自:医趋势